EudraVigilance基础介绍
EudraVigilance是一个管理和分析欧洲经济区(EEA)内已获批准或正在进行临床试验的药品的可疑不良反应信息的系统。欧洲药品管理局(EMA)代表欧盟(EU)药品监管网络运营该系统。
EudraVigilance分为两个模块:
- 临床试验模块:干预性临床试验申办方报告的疑似意外严重不良反应(SUSARs)。
- 上市后模块:疑似严重和非严重的不良反应来自
- ① 医护人员和患者的自发报告;
- ② 上市后研究(非干预性);
- ③ 世界范围内的科学文献(自发的、非干预性的)。
EudraVigilance通过以下方式来支持安全和有效地使用药物:
- ① EMA、国家主管部门(NCA)、上市许可持有人(MAH)和欧洲经济区的临床试验发起人之间以电子方式交换个例安全报告(ICSRs)
- ② 尽早发现和评估可能的安全信号
- ③ 为在欧洲经济区授权的药品提供更好的产品信息
有兴趣或需求想深入了解EudraVigilance,可以通过EMA官网的培训获得,培训链接:
EudraVigilance数据的获得
EudraVigilance提供了便利的途径,使得各利益相关方可以获得需要的数据。其中一种针对学术界、医疗保健专业人员、病人和普通公众,可以在“欧洲疑似药物不良反应报告数据库”中,进行检索获得目标数据。
EudraVigilance访问政策规定不同利益相关者群体对药品不良反应报告的有不同的访问水平
根据欧洲药品管理局(EMA)的EudraVigilance访问政策,包括上市许可持有人、监管机构、学术界、医疗保健专业人士和患者在内的利益相关者都可以访问EudraVigilance数据库中的数据。该政策旨在提供尽可能多的信息,同时满足数据保护义务。
不同的利益相关者(分为:MAH、欧洲经济区国家药品监管部门、学术界、医疗保健专业人员和病人和普通公众、WHO-UMC、EU外的监管机构)有不同的访问级别,具体访问界别可以通过以下链接详细了解:
https://www.ema.europa.eu/en/human-regulatory/research-development/pharmacovigilance/eudravigilance/access-eudravigilance-data
如对于医疗保健专业人员和病人和普通公众,访问水平如下截图:
Healthcare professionals, patients and the general public
| Data elements available | A restricted set of data elements for spontaneous reports is available and provided alongside detailed guidance on the nature and interpretation of the dataIncludes advice to patients not to change their medication without consulting a healthcare professional |
| Access tools | Publicly accessible European database of suspected adverse drug reaction reports |
“欧洲疑似药物不良反应报告数据库”检索方式
登录“欧洲疑似药物不良反应报告数据库” https://www.adrreports.eu/en/search.html,点击“Search”:
通过两种方式检索:商品名或活性成分,以商品名“KEYTRUDA”为例:
点击“KEYTRUDA”,弹出统计分析结果界面( 网上显示的数字是截至上周末报告的严重/非严重自发的疑似副作用病例的总和)
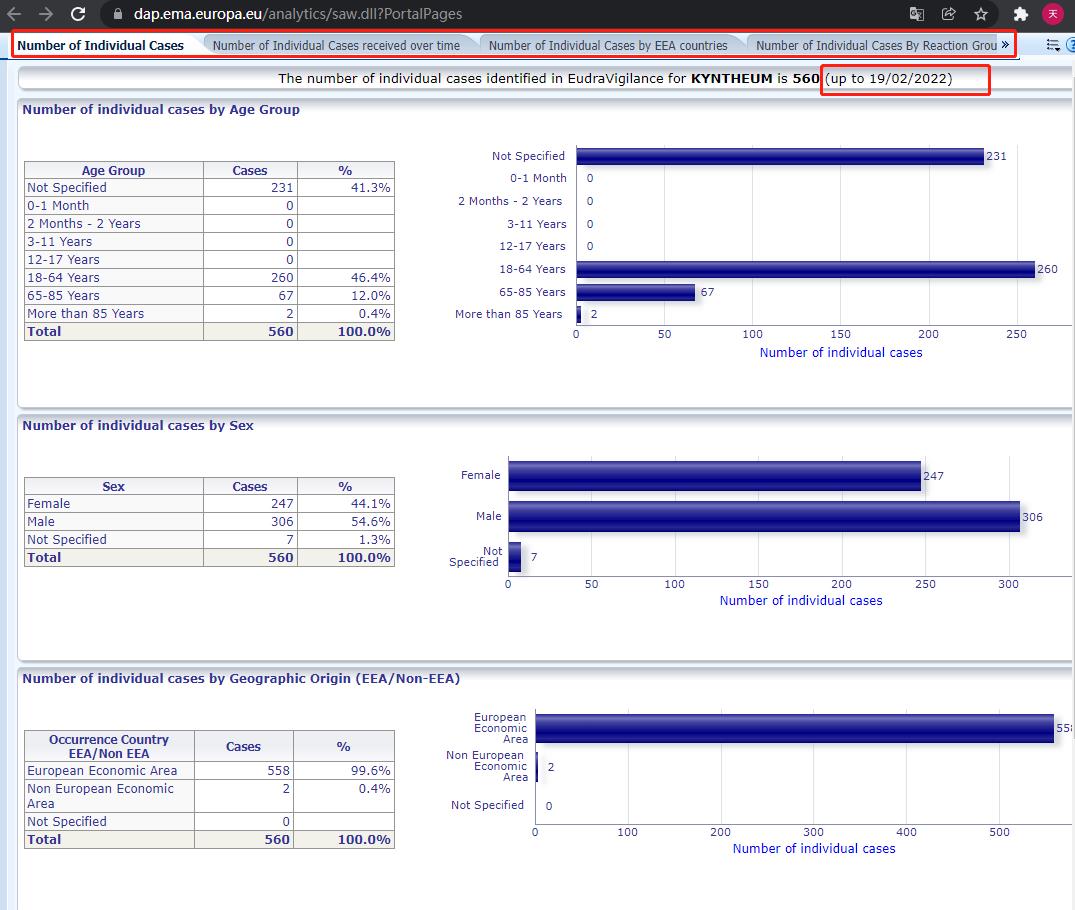
点击分屏,查看细分的统计分析结果。如果阅读统计报告存在问题,可以参考“用户指导”来解决:https://www.adrreports.eu/en/viewing_reports.html
